24-03-2025 - Chemistry Basics - Thermodynamics (part 4), enthalpy [EN]-[IT]

~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH
24-03-2025 - Chemistry Basics - Thermodynamics (part 4), enthalpy [EN]-[IT]
With this post I would like to give a brief instruction about the topic mentioned in the subject
(code notes: X_70)
Thermodynamics (part 4), enthalpy
Enthalpy
In thermodynamics the concept of enthalpy is one of the main concepts.
Below is the mathematical expression of enthalpy.
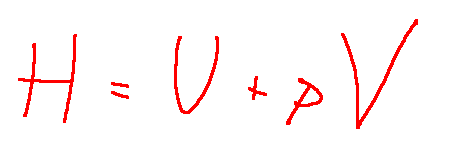
Where:
H = the enthalpy
U = the internal energy of the system,
p = the pressure of the system,
V = the volume of the system.
Basically, enthalpy is the sum of the internal energy and the energy due to the work done to expand the system against an external pressure. This would be pV.
Enthalpy in chemistry
If we enter the chemical field it is important to talk about Enthalpy variation

The enthalpy variation represents the difference between the final enthalpy and the initial enthalpy. When the process, in a system, occurs at constant pressure, the enthalpy variation corresponds to the heat exchanged by the system.
So we can make the following two deductions:
-If ΔH is greater than 0 the process is endothermic, that is, the system absorbs heat
-If ΔH is less than 0 the process is exothermic, that is, the system releases heat.
Enthalpy and internal combustion engine
First of all, let's clarify what internal combustion engines are. The engines of cars that run on gasoline, diesel and LPG (Liquefied Petroleum Gas) are all internal combustion engines.
We can understand how enthalpy is linked to internal combustion engines by examining the thermodynamic cycle that occurs inside an internal combustion engine.
In internal combustion engines, for example internal combustion engines, the fuel is burned and produces heat, which is transferred to the working fluid (very often a gas) inside the engine. At this point, the transferred heat increases the internal energy of the gas, which expands and thus does work on the engine's piston, generating movement.
However, we must be careful and not get confused.
The combustion of fuel is an exothermic chemical process. We said earlier that an exothermic chemical process produces heat.
So why isn't the internal combustion engine called exothermic?
Because the energy released in the form of heat increases the enthalpy of the gas inside the engine. This change in enthalpy (an increase) facilitates the expansion of the gases. In practice, we can say that the enthalpy increases during the combustion phase of the engine because the gas absorbs heat and its temperature increases.
So what we said before is valid, that is:
-If ΔH is greater than 0 the process is endothermic, that is the system absorbs heat

Chemical Reactions and Enthalpy
Let's take methane as an example. The molecular formula of methane is CH₄.
Methane is a compound formed by a carbon atom (C) and four hydrogen atoms (H). The bonds between the atoms are covalent bonds.
In methane (CH₄), electrons are shared between the carbon atom and the four hydrogen atoms to form covalent bonds.
Where:
Covalent bond = type of chemical bond in which two atoms share one or more pairs of electrons to achieve a more stable electronic configuration.
When methane, the main component of natural gas, burns in air, the reaction (called combustion) produces not only carbon dioxide and water but also a considerable amount of heat according to the following reaction:
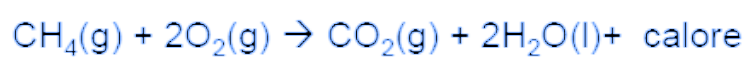
Since the process occurs at constant pressure (atmospheric pressure) we can apply the 1st Law written as ΔH=Q to the combustion reaction. In practice, the final state of the thermodynamic process is made up of the products that have formed (CO2 and H2O) while the initial state is made up of the reagents CH4 and O2). Therefore, the enthalpy variation associated with the chemical reaction (ΔH REAZ) is the difference between the enthalpy of the products at a certain temperature T (in kelvin) and the enthalpy of the reagents (at the same temperature T), all in the physical state indicated in the reaction. By the 1st Principle, ΔHREAZ=Q, that is, the enthalpy variation of the chemical reaction is equal to the color Q exchanged (>0 if the reaction is endothermic, <0 if the reaction is exothermic).
Below is a diagram of what was described above.
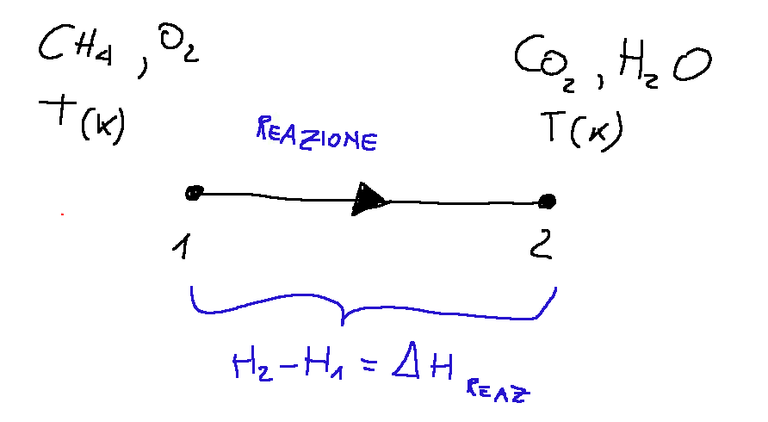
Where:
ΔH REAZ ≡ (enthalpy products) - (enthalpy reactants) = Q
Where:
≡ = symbol of identity or equivalence
Conclusions
The thermodynamic concept of enthalpy is closely linked to chemistry because it represents the total energy of a system. This energy includes that which can be exchanged in the form of heat during chemical reactions.
Question
In internal combustion engines (such as a petrol or diesel car engine), the chemistry of combustion increases the enthalpy of the gases inside the engine. Did you know that combustion chemistry and enthalpy change are the basis of how your car's engine works? (this is excluded if you have an electric car)

[ITALIAN]
24-03-2025 - Basi di chimica - Termodinamica (part 4), entalpia [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_70)
Termodinamica (part 4), entalpia
Entalpia
In termodinamica il concetto di entalpia è uno dei concetti principali.
Qui di seguito l'espressione matematica dell'entalpia.
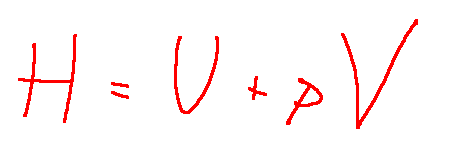
Dove:
H = l'entalpia
U = l'energia interna del sistema,
p = la pressione del sistema,
V = il volume del sistema.
Sostanzialmente l'entalpia è la somma dell'energia interna e dell'energia dovuta al lavoro fatto per espandere il sistema contro una pressione esterna. Questa sarebbe pV.
Entalpia in chimica
Se entriamo nell'ambito chimico è importante parlare di variazione di Entalpia

La variazione di entalpia rappresenta la differenza tra l'entalpia finale e quella iniziale. Quando il processo, in un sistema, avviene a pressione costante, la variazione di entalpia corrisponde al calore scambiato dal sistema.
Quindi possiamo fare le seguenti due deduzioni:
-Se ΔH è maggiore di 0 il processo è endotermico, cioè il sistema assorbe calore
-Se ΔH è minore di 0 il processo è esotermico cioè il sistema rilascia calore.
Entalpia e motore endotermico
Innanzitutto chiariamo quali sono i motori endotermici. I motori delle autovetture che vanno a benzina, diesel e a GPL (Gas di Petrolio Liquefatto) sono tutti motori endotermici.
Riusciamo a comprendere quanto l'entalpia è collegata ai motori endotermici esaminando il ciclo termodinamico che avviene all'interno di un motore endotermico.
Nei motori endotermici, per esempio quelli a combustione interna, il combustibile viene bruciato e produce calore, che viene trasferito al fluido di lavoro (molto spesso un gas) all'interno del motore. A questo punto il calore trasferito aumenta l'energia interna del gas, il quale si espande e così compie lavoro sul pistone del motore, generando movimento.
Bisogna però fare attenzione e non fare confusione.
La combustione del combustibile è un processo chimico esotermico. Prima abbiamo detto che un processo chimico esotermico rende calore.
Allora perché il motore endotermico non viene chiamato esotermico?
Perché l'energia rilasciata in forma di calore aumenta l'entalpia del gas che è all'interno del motore. Questa variazione di entalpia (un aumento) agevola l'espansione espansione dei gas. A livello pratico, possiamo dire che l'entalpia cresca durante la fase di combustione del motore perché il gas assorbe calore e la sua temperatura aumenta.
Quindi vale quello che abbiamo detto prima, cioè:
-Se ΔH è maggiore di 0 il processo è endotermico, cioè il sistema assorbe calore

Reazioni chimiche ed Entalpia
Prendiamo come esempio il metano. La formula molecolare del metano è CH₄.
Il metano è un composto formato da un atomo ci carbonio (C) e quattro atomi di idrogeno (H). I legami tra gli atomi sono legami covalenti.
Nel metano (CH₄), gli elettroni sono condivisi tra l'atomo di carbonio e i quattro atomi di idrogeno per formare i legami covalenti.
Dove:
Legame covalente = tipo di legame chimico in cui due atomi condividono uno o più coppie di elettroni per raggiungere una configurazione elettronica più stabile.
Quando il metano, il componente principale del gas naturale, brucia all’aria, la reazione (detta di combustione) produce non solo anidride carbonica e acqua ma anche una notevole quantità di calore secondo la reazione seguente:
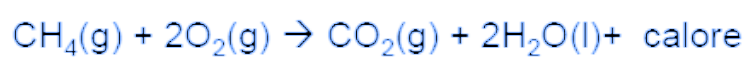
Poiché il processo avviene a pressione costante (pressione atmosferica) possiamo applicare il 1° Principio scritto come ΔH=Q alla reazione di combustione. In pratica lo stato finale del processo termodinamico è costituito dai prodotti che si sono formati (CO2 e H2O) mentre lo stato iniziale è costituito dai reagenti CH4 e O2). Quindi la variazione di entalpia associata alla reazione chimica (ΔH REAZ) è la differenza tra l’entalpia dei prodotti ad una certa temperatura T (in kelvin) e l’entalpia dei reagenti (alla stessa temperatura T), tutti nello stato fisico indicato nella reazione. Per il 1°Principio risulta ΔHREAZ=Q, cioè la variazione di entalpia della reazione chimica è uguale al colore Q scambiato (>0 se la reazione è endotermica, <0 se la reazione è esotermica).
Qui di seguito è riportato uno schema di quanto descritto sopra.

Dove:
ΔH REAZ ≡ (entalpia prodotti) - (entalpia reagenti) = Q
Dove:
≡ = simbolo di identità o equivalenza
Conclusioni
Il concetto termodinamico di entalpia è strettamente legato alla chimica perché rappresenta l'energia totale di un sistema. In questa energia è inclusa quella che può essere scambiata sotto forma di calore durante le reazioni chimiche.
Domanda
Nei motori endotermici (tipo un motore di un auto a benzina o diesel), la chimica della combustione aumenta l'entalpia dei gas all'interno del motore. Lo sapevate che la chimica della combustione e la variazione di entalpia sono alla base del funzionamento del motore della vostra auto? (questo è escluso se avete un auto elettrica)
THE END
I really love the fact that you always analyse the teaching to be so simple