Profundicemos en los Postulados de Borh
Es un placer estar nuevamente por acá compartiendo una vez más con todos ustedes. En la publicación presentada la ultima vez estuvimos hablando sobre el origen de la teoría de los cuantos, básicamente abordamos las contradicciones que la física clásica ha presentado en el nivel microscópico y se hizo una acotación sobre como Niels Borh intentando resolver la inestabilidad de los átomos abandonó completamente la idea que se tenía sobre el mecanismo de emisión de radiación por parte de los átomos y propuso tres importantes postulados, que en ésta ocasión trataremos de conocer un poco más.

Imagen realizada con la página web de diseño gráfico y composición de imágenes Canva.

Niels Bohr en sus estudios sobre los átomos nos brinda un panorama en el que el átomo, tiene un núcleo positivo y a su alrededor están los electrones en capas circulares alrededor de dicho núcleo. Bohr se apoyo en la teoría cuántica de Planck, los espectros de luz y el modelo atómico de Rutherford, para el año de 1913 este científico logro establecer su propio modelo, el cual ayudó para explicar los espectros de luz emitidos por los elementos y algunas irregularidades de la teoría clásica, así como también marca el comienzo de la era cuántica. Ahora bien, Bohr estableció tres postulados los cuales son:
En este postulado, se hablan de órbitas las cuales se les denominan “órbitas estacionarias”, esto se debe a que si no se emite energía, el electrón puede permanecer en ellas de manera indefinida; obviamente este postulado explica la existencia de átomos estables; sin embargo, aún nos falta por indagar sobre el mecanismo de emisión de radiación por el átomo, ya que si no las emite cuando se mueve en su órbita estacionaria lo debe hacer de otra manera. Este mecanismo de emisión de luz llamado onda electromagnética, lo propuso Borh cuando realiza su segundo postulado.
Para el segundo postulado Bohr establece dos partes, básicamente dicen algo así:
La energía electromagnética radiada no se trata más que de la diferencia de la energía del electrón en dichas órbitas, veamos la imagen que se muestra a continuación.
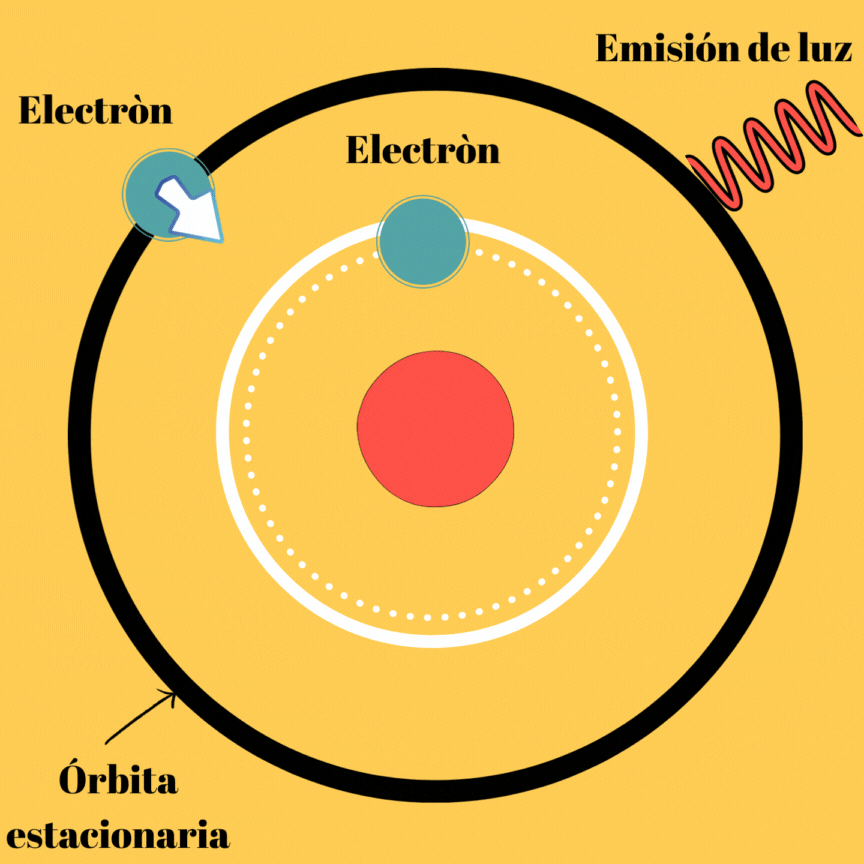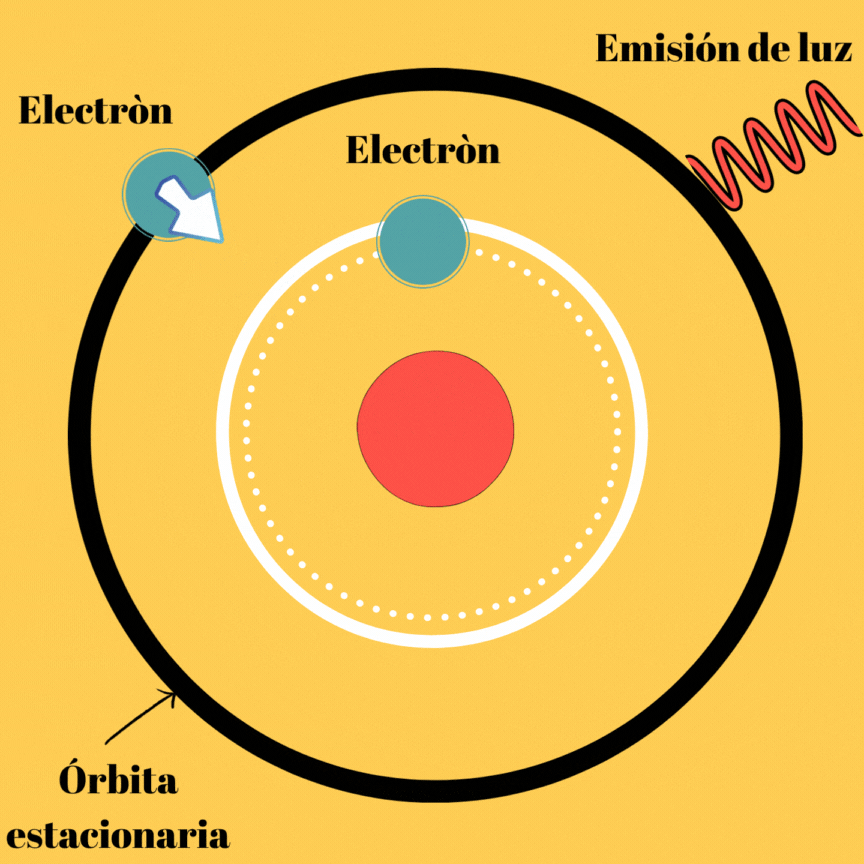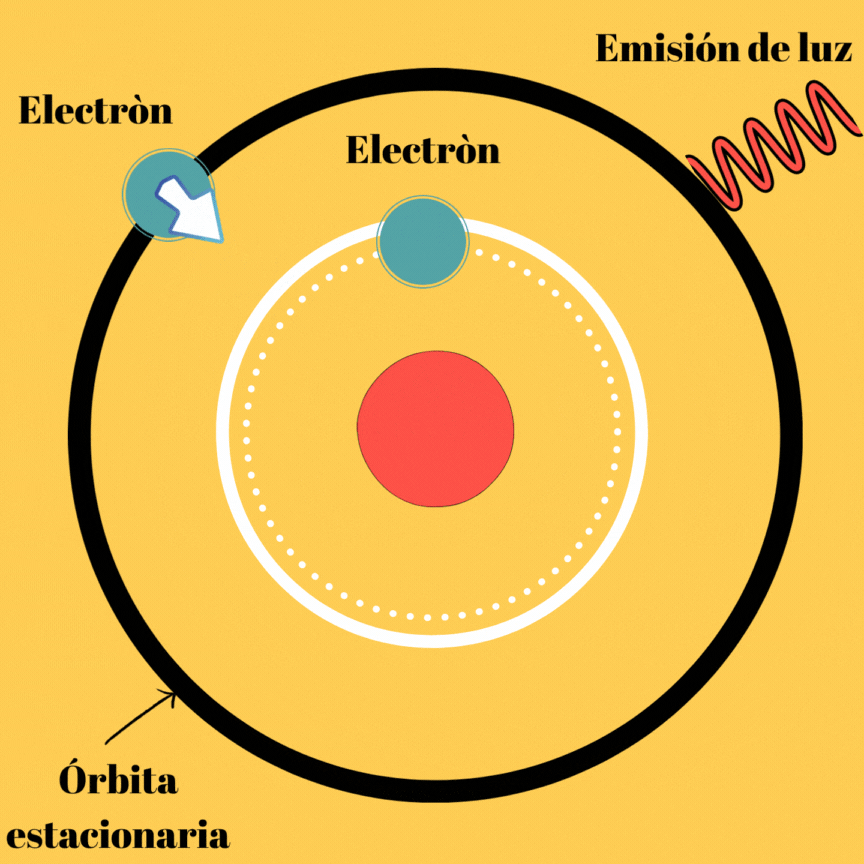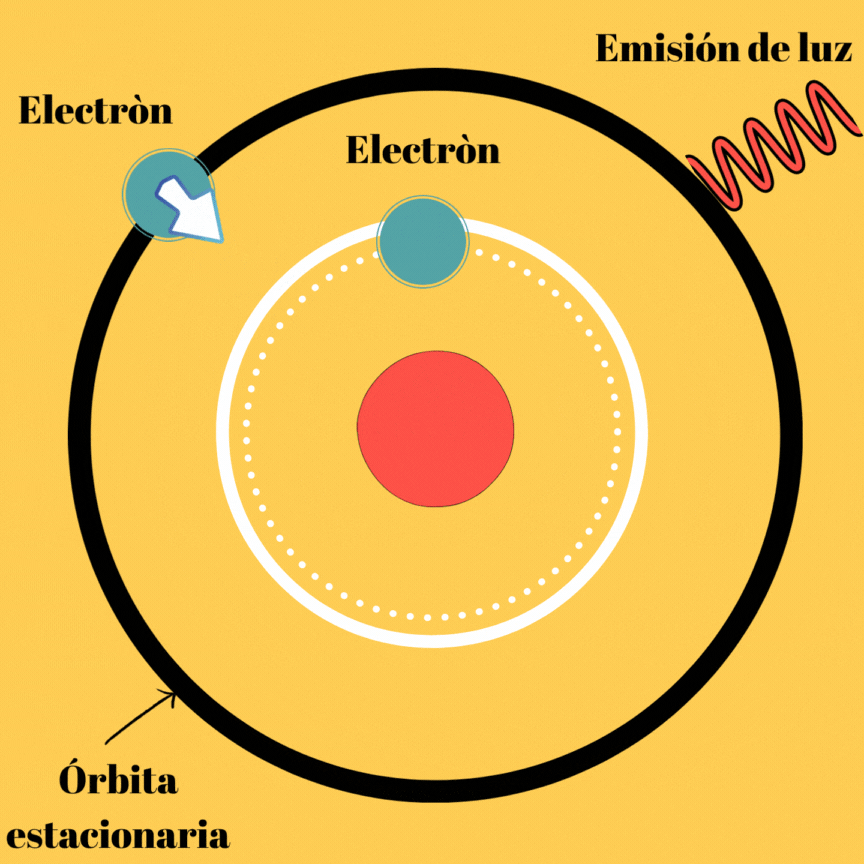
Diagrama realizado en Canva
Esta primera parte del segundo postulado, nos muestra el por qué a pesar de existir órbitas estacionarias, el átomo puede emitir radiación electromagnética. Aunque todavía podemos notar que no existe ningún tipo de relación entre el movimiento del electrón y la frecuencia de la radiación emitida.
En esta expresión, f es la frecuencia, ΔE es la variación de la energía y h es la constante de Planck y su valor es de…
Veamos un ejemplo práctico. Si deseamos calcular la frecuencia de la radiación emitida por un electrón que salta de una órbita estacionaria cuyo radio es 9Å a otra de radio 0,5Å.
Lo primero que debemos saber es que:
Para conocer la energía mecánica del electrón en las órbitas, utilizaremos la siguiente ecuación:
Para el caso de un átomo de hidrógeno, q1 y q2 son iguales, por ende se utiliza la carga del electrón. Entonces, calculamos para R1 y luego R0.
Para R0
Con estos dos valores podemos obtener la diferencia de energía, que es:
Ahora podemos calcular la frecuencia de la radiación emitida
Por lo tanto, la frecuencia de la radiación emitida por el electrón cuando el mismo pasa de una órbita a otra es de 22,9 x 10 exp 15 Joule.
Ahora bien, los dos primeros postulados nos permiten construir un modelo de átomo estable, sin embargo, ninguno de estos postulados impide que el electrón ocupe cualquier órbita circular; pero como el átomo emite un espectro discreto, es decir, emite solo en ciertas frecuencias, esto nos lleva a concluir que no todas las órbitas son posibles. Y para limitar entonces el número de órbitas, Borh realizó el tercer postulado.
Cuando Borh emitió su teoría, en contradicción con las ideas fundamentales de la física que habían estado vigente durante el siglo XIX, los físicos de la época ya no podían sorprenderse, tanto menos que los postulados de Borh coincidían perfectamente con las afirmaciones de Planck, que decía “la vieja física, el edificio glorioso que había desafiado los siglos, era inadecuado a los dominios del átomo”.
Posteriormente, justo unos años más tarde, la misma física construida por Galileo y Newton se hacia también incompatible con el campo de las velocidades del orden de la velocidad de la luz, campo en el cual habría que recurrir a la mecánica de Einstein.
Como ya lo hemos venido mencionando a lo largo de varias publicaciones, la física moderna hace su entrada con el estudio del espectro de las radiaciones emitidas por un cuerpo negro. Una esfera hueca de hierro calentada exteriormente por circulación de vapor mediante una corriente eléctrica y que tenga en su superficie un pequeño orificio, constituye un modelo del cuerpo negro, el cual puede ser capaz de absorber del todo cualquier tipo de radiación. También, puede ser viable llamarlo radiador integral, en sustitución de cuerpo negro, ya que a una temperatura muy elevada el cuerpo negro emite luz, lo cual no concuerda con su nombre.
En un cuerpo como el que mencionamos, si lo llevamos a una temperatura elevada y uniforme, el interior aparece incandescente y es un hecho que todos los cuerpos encerrados dentro de este horno toman el mismo color. Ese color, producto de la irradiación de incandescencia, es característico de la temperatura del horno y no depende de la sustancia calentada. Si analizamos esta energía radiada, aparece compleja, pues engloba una gama de radiaciones simples, visibles e invisibles, cada una con una intensidad propia, de modo tal que el conjunto tiene una composición espectral bien definida. Cabe resaltar, que se puede medir la intensidad correspondiente de cada radiación.
Ya hemos mencionado varias veces la imagen representativa de la estructura cristalina metálica, y resulta que también es posible explicar la radiación térmica de los iones positivos de dichos metales, que como fuerza básica de la estructura se encuentran unidos en planos de redes regulares definidamente localizadas, no están rígidos e inmóviles. Efectúan bajo condiciones normales, pequeños movimientos oscilantes alrededor de sus peculiares lugares de posición. Estas vibraciones permanentes pueden considerarse de nuevo como un movimiento pendular de conductores de carga eléctrica. La consecuencia de esto es la formación de un campo electromagnético que se exterioriza como una radiación térmica. La desviación del péndulo ion; su amplitud de oscilación, depende de la temperatura. Es decir, que cuando la temperatura aumenta, la energía varia la cuarta potencia de la temperatura (T elevada a la 4); este acontecimiento se traduce en los resultados de hechos corrientes, donde el color de los cuerpos incandescentes, primeramente el rojo oscuro, se transforma en rojo cereza, siguiendo hasta el rojo claro, y por fin llega a blanco para temperaturas más altas. Las frecuencias de estas radiaciones térmicas se encuentran entre los (10 elevado a la 12 y 10 elevado a la 14) Hertz.
Es importante saber que todas las sustancias emiten radiación electromagnética, y que las características dependen de la naturaleza y a temperatura de las sustancias. Es por ello, que para lograr dar una explicación a los resultados obtenidos, el científico Max Planck se refugió en una hipótesis completamente nueva, esto partiendo del hecho que, los supuestos osciladores contenidos en la materia incandescente, en lugar de poseer una energía E cualquiera, como quiere la electrodinámica clásica, “no puede poseer más que energías discretas, es decir, variando a saltos, por escalones iguales”.
Partiendo de ese hecho, fue como Planck se dedicó a la tarea de adivinar e inventó el cuanta o quanto, demostrando con ello que la radiación electromagnética es absorbida o emitida solamente en paquetes de saltos de energía, esto quiere decir, que la radiación era emitida discontinuadamente como pequeñas irrupciones de energía. Estas irrupciones se les denomina cuantos, y de allí proviene la aparición de las bandas negras en los espectros discontinuos de la radiación del cuerpo negro. Para la radiación de una frecuencia determinada (f) este paquete cuanto de energía viene dado por la siguiente expresión:
Donde h es la constante de Planck, y resulta fácil notar que las dimensiones de h son las de energía multiplicada por tiempo, o sea, de una acción. En conclusión, no es en la energía en lo que Planck admitía la variación discontinua, es decir, los saltos bruscos, sino la acción.
Posteriormente se aceptó que los cuantos de las radiaciones no contenían todos exactamente la misma cantidad de energía. Esto quiere decir, que cuanto más alta es la frecuencia de la radiación, más ricos serán en energía los cuantos, por consiguiente, la radiación con baja frecuencia. Por ejemplo la luz violeta posee una frecuencia casi igual al doble de que le corresponde a la luz roja oscura. Por lo tanto, cada cuanto de luz violeta tiene el doble de la energía de cada cuanto de luz oscura.
El acontecimiento de que la energía empacada en porciones parece a simple vista algo mágico y sorprendente. Sin embargo, realmente es un artificio sencillo que pude ser muy útil para la descripción de un modelo. Sin nos olvidamos un momento del modelo de Rutherford como un modelo planetario, podríamos considerar al átomo con un dispositivo automático que solo absorbe y devuelve paquetes de energía. Si volvemos a analizar la física clásica, ella realiza una distinción entre ondas y partículas. A la partícula la ve como una localización en el espacio, la cual se caracteriza por una masa definida m, que se puede mover al cualquier velocidad v, y que la energía cinética de la misma se encuentra relacionada con su masa y su velocidad, es decir, bajo la siguiente expresión:
Por su parte, a la onda la ve como una extensión en el espacio y se caracteriza por una velocidad definida, que puede tener cualquier amplitud A y frecuencia f. Para la física clásica, un electrón es una partícula y la luz es una onda.
Pero, la mecánica cuántica hace una observación distinta, y caracteriza de una manera muy particular la diferencia entre una onda y una partícula, ella dice que todas son entidades, es decir, que tanto la luz como los electrones tienen una naturaleza semejante a la onda y a una partícula, partiendo de este hecho, la ciencia obtuvo cambios trascendentales y por ende el desarrollo de la humanidad también.
Referencias
Resnick, R; Halliday, D & Krane, K. (2007). Física volumen 2. México: Grupo Editorial Patria.
Sánchez, E. (2005). Física. Caracas: Ediciones CO-BO.
Zemansky, S. (2009). Física Universitaria Volumen II. México: Pearson Educación.



0
0
0.000
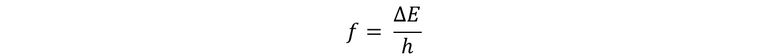
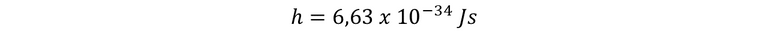
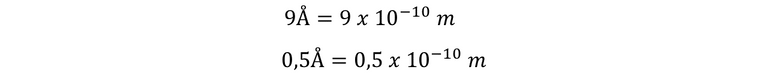
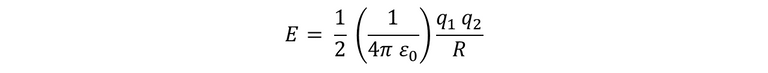
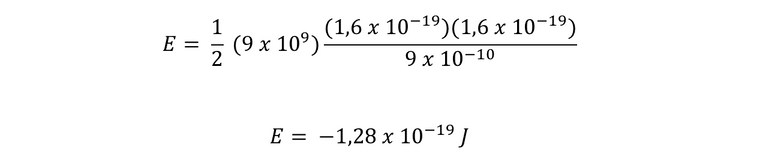
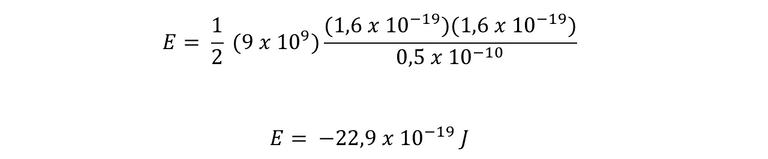
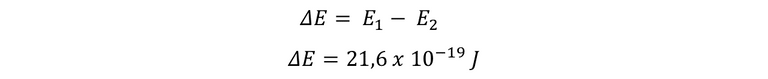
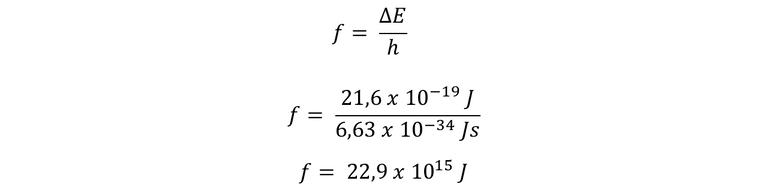

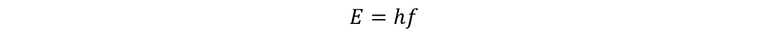
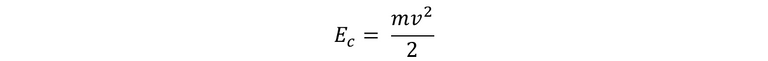
https://twitter.com/345684731/status/1644125347850469380
The rewards earned on this comment will go directly to the people sharing the post on Twitter as long as they are registered with @poshtoken. Sign up at https://hiveposh.com.
https://twitter.com/ILovePhysica/status/1644125347850469380?s=20
Congratulations @hannymarchan! You have completed the following achievement on the Hive blockchain And have been rewarded with New badge(s)
Your next target is to reach 2250 replies.
You can view your badges on your board and compare yourself to others in the Ranking
If you no longer want to receive notifications, reply to this comment with the word
STOPCheck out our last posts:
Support the HiveBuzz project. Vote for our proposal!
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.
Qué tema tan espectacular el que has desarrollado en este post. Hace tiempo vengo empapándome con los principios elementales de la física cuántica. Ver que has hecho algo referido a Borh es sencillamente maravilloso. Debo confesarte, que he aprendido mucho con tu explicación. Te animo a que no dejes de hacer este tipo de contenido tan espectacular, dinámico y útil. Un abrazo enorme, @hannymarchan
Leí el título de este post, y me hizo recordar al primer semestre en la universidad cuando en química I - ⚗️ química general nos hablan de las teorías y modelos atómicos :)